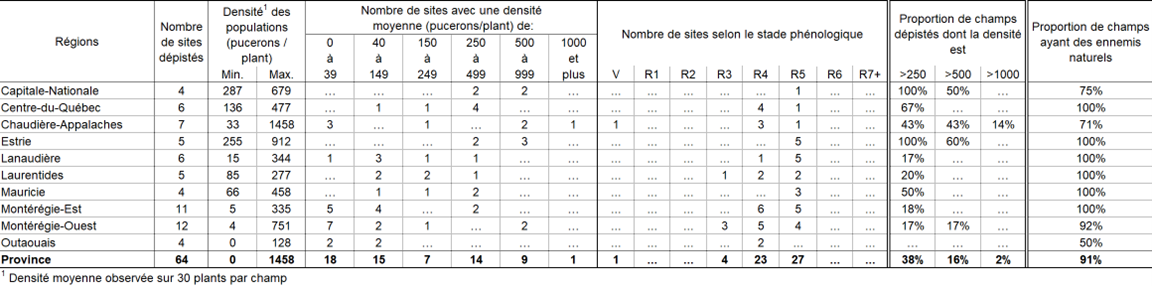
PUCERON DU SOYA : POURSUIVEZ LE DÉPISTAGE DES CHAMPS AVEC DE FORTES POPULATIONS DE PUCERONS QUI N'ONT PAS ENCORE ATTEINT LE STADE R5
S. Mathieu1, S. Boquel2, V. Samson1, M.-E. Cuerrier1, J. Saguez2, B. Duval1 et J. Breault1
1. Agronome (MAPAQ); 2. Chercheur (CÉROM)
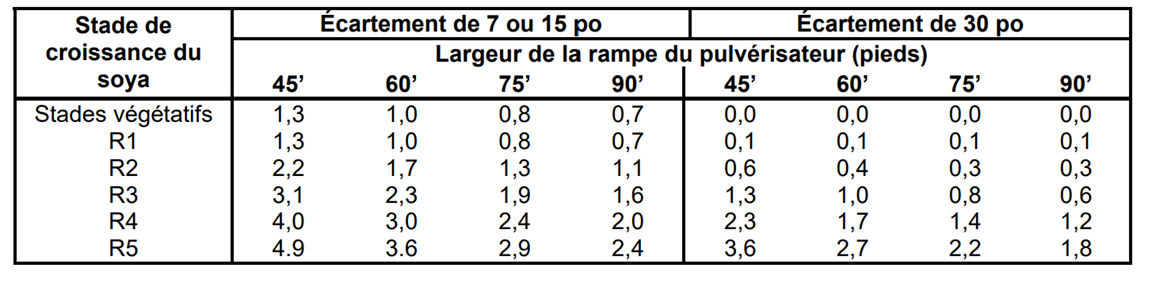
En plus de la perte de rendement estimée, les pertes dues à l’écrasement des plants de soya par le passage du pulvérisateur, la largeur de la rampe, le stade du soya, le rendement espéré, le prix de vente du soya, etc. doivent aussi être considérés dans le calcul de rentabilité.
de la rampe
| Risque élevé, si stade R4 pas atteint | |
| Centre-du-Québec | Saint-Christophe-D'Arthabaska |
| Victoriaville | |
| Chaudière-Appalaches | Beauceville |
| East Broughton | |
| Saint-Éphrem-de-Beauce | |
| Estrie | Lawrenceville |
| Saint-Georges-de-Windsor | |
| Lanaudière | Saint-Michel-des-Saints |
| Laurentides | Brownsburg-Chatham |
| Ferme-Neuve | |
| Mirabel | |
| Mont-Tremblant | |
| Papineau-Labelle | |
| Montérégie-Est | Farnham |
| Frelighsburg | |
| Mont-Saint-Hilaire | |
| Montérégie-Ouest | Mont-Saint-Grégoire |
| Outaouais | Saint-André-Avellin |
| Risque modéré, si stade R4 pas atteint | |
| Capitale-Nationale | Cap-Tourmente |
| Estrie | Lac-Brome |
| Laurentides | Arundel |
| Mont-Laurier | |
| Oka | |
| Mauricie | Saint-Barnabé |
| Sainte-Geneviève-de-Batiscan | |
| Montérégie-Est | Dunham |
| Saint-Bruno-de-Montarville | |
| Outaouais | La Pêche |
| Masson | |
| Val-des-Monts | |
Rappelons que les modèles prévisionnels* pour la pourriture à sclérotes chez le soya utilisent uniquement des facteurs météorologiques pour prédire la présence d’apothécies. De plus, les prédictions sont valables pour cinq jours. Les conditions météorologiques peuvent changer, créant des fluctuations de risques. Comme le stade critique du soya est dépassé dans la majorité des régions le rendant maintenant moins sensible à l’infection par la pourriture à sclérotes, ceci est le dernier avertissement de la série pour cette maladie.
INSECTES DÉFOLIATEURS DANS LE SOYA : FAUT-IL S'INQUIÉTER?
1. Chercheur (CÉROM); 2. Agronome (MAPAQ)
Au cours de la dernière semaine, des insectes défoliateurs s’alimentant sur les feuilles du soya ont été observés. Ces ravageurs secondaires incluent le scarabée japonais et les criquets (voir photos ci-dessous). On constate souvent la présence de ces insectes en foyers à ce moment-ci de l’année. Ils s’alimentent du feuillage du soya, mais peuvent aussi être observés dans d’autres cultures. Selon le moment de la saison, d’autres ravageurs pourront être observés, comme la chrysomèle du haricot, l’altise à tête rouge, les chenilles de belle dame ou le méloé cendré. Comme ces insectes s’alimentent du feuillage, les dommages peuvent être impressionnants visuellement. Toutefois, ils sont souvent très localisés et les dommages d’importance économique sont rares.
Afin de savoir s’il y a un risque de perte de rendement, évaluez le pourcentage de défoliation du soya. Le soya peut tolérer jusqu’à 30 % de défoliation aux stades végétatifs, sans pertes de rendement, et jusqu’à 15 % de défoliation entre les stades début floraison (R1) et remplissage des gousses (R4). En général, en Amérique du Nord, une intervention n’est suggérée que si ces seuils sont dépassés.
Il est possible d’évaluer le pourcentage de défoliation visuellement. Vous pouvez vous entraîner en utilisant l’outil Crop Scouting Training (en anglais). Il est aussi possible, à partir de photos de feuilles trifoliées, de mesurer le taux de défoliation en utilisant les applications numériques BioLeaf (pour Android) et LeafByte (pour Apple).
Si une intervention phytosanitaire devait être envisagée, il faudrait considérer la présence d’insectes bénéfiques dans la culture (ex. : coccinelles, syrphes, cécidomyies) qui permettent aussi de contrôler les populations de pucerons du soya. Les scarabées japonais peuvent aussi être parasités; le parasitoïde assure un bon contrôle des spécimens affectés sans autre intervention nécessaire.
Consultez le site Web SAgE pesticides pour connaître les produits homologués au Québec et les risques (IRS et IRE) qui y sont reliés. Pour en savoir plus sur les défoliateurs du soya, consultez le bulletin d'information Défoliation du soya par divers ravageurs : méloé cendré, criquets, scarabée japonais, altises, limaces, etc.
Si vous observez des cas de défoliation majeure, communiquez avec votre conseiller en grandes cultures du MAPAQ et la coordonnatrice du RAP Grandes cultures (rapcerom@cerom.qc.ca).
VGOH : POURSUIVEZ LE DÉPISTAGE DES MASSES D'OEUFS DANS LE MAÏS
1. Chercheur (CÉROM); 2. Agronome (MAPAQ)
Cette semaine encore, les captures de papillons du ver-gris occidental des haricots (VGOH) ont continué d’augmenter dans toutes les régions du Québec. Cela signifie que la ponte pourrait se poursuivre dans des champs présentant des facteurs de risque (ex. : sol sableux ou loam sableux, maïs se situant près du stade de la floraison, champs de maïs présentant une croissance inégale). Le dépistage des masses d’œufs est donc toujours recommandé dans ces champs.
Des masses d’œufs ont été observées dans 40 % des champs dépistés par le RAP Grandes cultures (15 champs parmi 37). Des masses d’œufs ont été observées dans les régions suivantes : Chaudière-Appalaches, Lanaudière, Laurentides, Montérégie et Outaouais. Quatre sites situés dans les Laurentides et en Outaouais dépassent le seuil d’intervention de 5 % de plants avec des masses d’œufs.
Tous les œufs d’une même masse sont pondus en même temps et devraient se développer à la même vitesse. Au cours des quelques jours de leur développement, les masses d’œufs changent de couleur, passant du blanc au rosé, puis au mauve juste avant l’éclosion. Lors du dépistage des masses d’œufs, portez une attention particulière à l’état des masses d’œufs. Cela peut donner une indication sur le développement des larves à l’intérieur des œufs et aussi de déterminer s’il y a du parasitisme ou si les œufs sont viables. L’utilisation d’une loupe ou de la fonction « loupe » de votre téléphone cellulaire peut permettre de mieux observer les masses d’œufs.
Voici quelques exemples de ce qui peut être observé (photos prises avec un téléphone cellulaire, zoom X 5).
Certaines masses d’œufs peuvent être de différentes couleurs. Ces masses d’œufs peuvent présenter une ou plusieurs problématiques.
Pour en savoir plus sur le dépistage du VGOH et les stratégies d’intervention :
- Fiche technique Ver-gris occidental des haricots dans le maïs (grain et ensilage);
- Vidéo Le ver-gris occidental des haricots : biologie, dépistage et stratégies d’intervention.
POLLINISATION DU MAÏS : SURVEILLEZ LES INSECTES QUI S'ALIMENTENT SUR LES SOIES
B. Duval1, J. Saguez2 et M.-É. Cuerrier1
1. Agronome (MAPAQ); 2. Chercheur (CÉROM)
Des chrysomèles des racines du maïs, des altises à tête rouge et des scarabées japonais sont observés dans différentes cultures, dont le maïs de grandes cultures.
Les soies du maïs font partie de leur alimentation et cela peut nuire à la pollinisation dans certains cas plutôt rares. Le rendement du maïs-grain peut être affecté si les trois conditions suivantes sont réunies au moment du dépistage :
- Moins de la moitié des épis sont pollinisés. Pour déterminer si la pollinisation du maïs est complétée, récoltez quelques épis bien répartis dans le champ. À l’aide d’un couteau, coupez la base de l’épi, incisez les spathes (les feuilles entourant l’épi) dans le sens de la longueur, détachez délicatement les spathes de l’épi et secouez légèrement l’épi. Si les soies sont toujours attachées à l’épi, cela indique que la pollinisation n’a pas eu lieu. Si les soies sont brunes et/ou qu’elles se détachent de l’épi, cela indique que la pollinisation est terminée. Vous pouvez consulter une vidéo (en anglais) réalisée par l’Université de Purdue, qui démontre cette méthode (ear shake test). Pour plus d’information sur la pollinisation, consultez l’avertissement N° 35 du 27 juillet 2016.
- La portion de soies sortant de l’épi mesure moins de 1,3 cm (0,5 po).
- Les ravageurs sont présents et s’alimentent sur les soies :
- Altise à tête rouge : pas de seuil économique d’intervention disponible.
- Chrysomèles des racines du maïs : l’Université de l’Iowa utilise un seuil de cinq individus ou plus par plant.
- Scarabée japonais : certains États américains utilisent un seuil de trois adultes et plus par épi.
Il est rare qu’un traitement insecticide soit justifié pour protéger les soies du maïs. Advenant que ce soit le cas, peu d’insecticides sont homologués au Québec pour lutter contre ces insectes dans le maïs : un seul insecticide foliaire est homologué contre les altises et aucun insecticide foliaire n’est homologué pour les deux autres insectes.
COLORATION ANORMALE DE LA LUZERNE, À QUOI L'ATTRIBUER?
G. Régimbald1, N. Hallé2, A. Dionne3, V. Samson1, D. Abdi4 et J. Saguez4
1. Agronome (MAPAQ); 2. Technicienne (MAPAQ); 3. Phytopathologiste (LEDP-MAPAQ); 4. Chercheur (CÉROM)
Plusieurs cas de coloration suspecte sont actuellement rapportés dans les champs de luzerne. Les cicadelles peuvent être l’une des causes. En effet, les cicadelles de la pomme de terre sont encore présentes et peuvent causer une coloration jaune à pourpre en forme de V à la pointe des feuilles lorsque la pression est élevée. Le bout des feuilles affectées peut aussi sécher. Cependant, les dépistages de cette année démontrent des populations relativement faibles dans plusieurs régions et la fauche suffit à la contrôler dans la plupart des cas.
Certaines décolorations pourraient être attribuées à une carence en éléments minéraux, tel que le bore (consultez la fiche Comment fertiliser et détecter les carences dans nos luzernières).
Dans d’autres cas, il peut s’agir de maladies foliaires. À cette période-ci de l’année, elles commencent à paraître davantage selon les régions et le stade de la culture. Les plus courantes sont la tache de poivre, la tache commune et la tige noire (voir photos ci-dessous).
Il est à noter que souvent, plus d’une maladie peuvent être présentes simultanément, ce qui rend le diagnostic et leur identification plus complexes. N’hésitez pas à recourir aux services du Laboratoire d’expertise et de diagnostic en phytoprotection du MAPAQ pour documenter la situation.
DÉPISTAGE DES MAUVAISES HERBES ET DÉTECTION DE RÉSISTANCES
Publication originale 2022 : S. Mathieu1, B. Duval1 et S. Flores-Mejia2
Révision 2024 : M.-É. Cuerrier1, B. Duval1, V. Samson1 et A. Picard3
1. Agronome (MAPAQ); 2. Chercheuse (CÉROM); 3. Agronome-malherbologiste (LEDP-MAPAQ)
Le mois d’août est une bonne période pour observer la présence de mauvaises herbes qui ont échappé au contrôle des herbicides appliqués plus tôt en saison. À ce temps-ci de l’année, les mauvaises herbes non contrôlées dépassent généralement la canopée et sont ainsi plus facilement détectables. Au Québec, plusieurs espèces de mauvaises herbes ont déjà été confirmées résistantes à certains herbicides, dont la petite herbe à poux, l’amarante tuberculée, la morelle noire de l’Est, la moutarde des oiseaux, la vergerette du Canada, la folle avoine, l’amarante à racine rouge, le chénopode blanc, la sétaire verte (voir photos ci-dessous), etc. Consultez le Portrait de la résistance des mauvaises herbes au Québec (2011-2023)
Établir un diagnostic de résistance des mauvaises herbes
Lors du dépistage, identifiez les mauvaises herbes non réprimées et notez leur emplacement, leur densité et leur stade de développement (cette vidéo vous permettra de reconnaître les signes de la résistance des mauvaises herbes aux herbicides et d’en faire une bonne évaluation). Ces observations vous permettront de mieux comprendre les raisons du mauvais contrôle. Attention! Une mauvaise herbe non contrôlée n’est pas nécessairement résistante à l’herbicide utilisé. Les éléments suivants renforcent l’hypothèse de la résistance aux herbicides :
- Une seule espèce de mauvaise herbe a survécu au traitement;
- Le patron de distribution de la mauvaise herbe au champ est aléatoire;
- Dans cette population de mauvaises herbes, le niveau de dommages dus à l’herbicide varie d’une plante à l’autre;
- Le même problème a été observé au cours des dernières années dans un même champ, lorsque des herbicides du même groupe ont été utilisés;
- Des herbicides du même groupe ont été utilisés à répétition, année après année, dans ce champ.
Si tel est le cas, le diagnostic de résistance des mauvaises herbes permettra d’ajuster la stratégie de désherbage pour les années à venir, et évitera des applications inefficaces d'herbicides et des pertes potentielles de rendement.
Si vous soupçonnez un problème de résistance aux herbicides, des tests de détection de la résistance sont offerts pour certaines espèces par le Laboratoire d’expertise et de diagnostic en phytoprotection (LEDP). Consultez la trousse Résistance des mauvaises herbes pour découvrir la liste des tests disponibles, les méthodes pour échantillonner les mauvaises herbes et plus encore.
Pour éviter de sélectionner des mauvaises herbes résistantes aux herbicides, il est important de bien connaître la biologie des mauvaises herbes, de dépister régulièrement les champs, tout au long de la saison, d’utiliser différentes méthodes de contrôle, de faire des rotations incluant des cultures à cycles long et court, et de varier les modes d’action des herbicides utilisés. Pour comprendre la biologie de quelques mauvaises herbes fréquemment confirmées résistantes à des herbicides et établir une stratégie de lutte contre celles-ci, consultez les fiches techniques sur l’amarante tuberculée, la folle avoine, la morelle noire de l’Est et la petite herbe à poux.
Pour des renseignements complémentaires, vous pouvez contacter le personnel du LEDP du MAPAQ au 418 643-5027, poste 2718, ou à phytolab@mapaq.gouv.qc.ca. De plus, pour la saison de culture 2024, le LEDP poursuit son offre d'aide à l'identification de mauvaises herbes par l'envoi d'images par courriel à l’adresse courriel suivante : mauvaiseherbe@mapaq.gouv.qc.ca.
Poursuite du Plan de lutte contre l’amarante tuberculée
Le Plan d’intervention phytosanitaire pour lutter contre l’amarante tuberculée (Plan) se poursuit jusqu’en décembre 2024. Une entreprise qui découvre de l’amarante tuberculée en 2024 est ainsi invitée à s’inscrire au Plan afin de bénéficier de l’aide financière disponible pour maitriser cette espèce. De même, une entreprise qui souhaite poursuivre la lutte à l’amarante tuberculée peut se réinscrire en 2024 si elle n’a pas déjà utilisé l’entièreté de son aide financière disponible.
Pour plus d’information, vous pouvez vous rendre au amarantetuberculee.ca.
Gratuité pour les amarantes
Les tests pour l’identification et la détection de la résistance aux herbicides pour les amarantes sont offerts gratuitement par le LEDP en 2024.
| Toute intervention envers un ennemi des cultures doit être précédée d’un dépistage et de l’analyse des différentes stratégies d’intervention applicables (prévention et bonnes pratiques, lutte biologique, physique et chimique). Le Réseau d’avertissements phytosanitaires (RAP) préconise la gestion intégrée des ennemis des cultures et la réduction des pesticides et de leurs risques. |
Pour des renseignements complémentaires, vous pouvez contacter l’avertisseure du sous-réseau Grandes cultures ou le secrétariat du RAP. Édition : Marianne St-Laurent, agr., M. Sc. et Lise Bélanger (MAPAQ). La reproduction de ce document ou de l’une de ses parties est autorisée à condition d'en mentionner la source. Toute utilisation à des fins commerciales ou publicitaires est cependant strictement interdite.