Ver-gris noir : cas rapportés, continuez la surveillance et le dépistage. Dommages de criquets dans le Bas-Saint-Laurent. Cécidomyie du chou-fleur dans le canola. Les risques d'infection de la fusariose de l'épi dans le blé d'automne. L'importance de vérifier l'efficacité d'un traitement herbicide après une intervention.
1. Chercheur (CÉROM); 2. Agronome (MAPAQ)
De nouveaux cas de dommages importants par le ver-gris noir ont été rapportés au RAP Grandes cultures, dans les régions plus périphériques cette fois. Ces cas ont été observés en Abitibi-Témiscamingue, dans des champs de canola, de céréales et de maïs, dans les municipalités de Béarn, Duhamel-Ouest, Notre-Dame-du-Nord, Saint-Bruno-de-Guigues, Saint-Eugène-de-Guigues et Saint-Édouard-de-Fabre, ainsi qu’en Estrie, à Courcelles dans la culture de maïs. Les larves de stade 4 et plus sont les plus dommageables, car elles peuvent couper les plants de maïs à leur base jusqu’aux stades 5-6 feuilles de la culture. L’avertissement N° 6 du 7 juin 2024 présente les facteurs favorisant la présence de l’insecte ainsi que la méthode de dépistage.
Dans plusieurs régions, les cultures sont encore au début de leur croissance, avec une levée tardive. Elles peuvent donc être la cible du ver-gris noir. Il est donc important de poursuivre le dépistage des champs à risque afin de déceler les larves et les dommages. Il pourra ensuite être possible de déterminer si une intervention phytosanitaire est nécessaire, tout en tenant compte du stade de développement de la culture, du niveau de dommage et de la taille des larves. La plupart des produits sont peu efficaces lorsque l’insecte a atteint les derniers stades larvaires. Il est nécessaire de dépister les champs dès l’apparition des premiers dommages et d’intervenir avant que la majorité des larves n’atteignent une longueur de plus de 25 mm.
En cas de dommages importants, veuillez en informer votre conseiller régional du MAPAQ et le RAP Grandes cultures.
Pour de plus amples informations sur la méthode de dépistage, les seuils et la stratégie d’intervention, veuillez consulter la fiche technique Ver-gris noir.
DOMMAGES DE CRIQUETS RAPPORTÉS DANS LE BAS-SAINT-LAURENT
1. Agronome (MAPAQ); 2. Chercheur (CÉROM)
Des dommages de criquets ont récemment été rapportés dans un champ de soya dans la région du Bas-Saint-Laurent. Ces dommages se sont traduits par une défoliation partielle ou complète des plants. Puisque le temps chaud et sec favorise leur développement et leur migration à partir des bordures de champs vers l’intérieur de ceux-ci, les populations de criquets seront à surveiller dans les prochaines semaines. Les champs de soya en sol sableux sont particulièrement à surveiller, puisqu'ils sont souvent les premiers affectés par les criquets, d’autant plus si ces champs sont adjacents à des prairies récemment fauchées. Une attention particulière devra aussi être portée aux champs en travail réduit du sol et fortement infestés par des graminées.
Les criquets, souvent appelés à tort « sauterelles », peuvent s’attaquer au feuillage du soya, du maïs, des céréales, ainsi qu’aux prairies et pâturages. Il est assez rare que les criquets causent des dommages suffisamment importants pour justifier une intervention phytosanitaire. Dans le cas où une intervention serait justifiée, cette dernière doit être effectuée lorsque les criquets sont encore au stade nymphal (absence d’ailes) et qu’ils s’alimentent activement du feuillage des cultures. Certaines précautions doivent également être prises afin de préserver les insectes bénéfiques. Pour plus d’information, consultez Les criquets en grandes cultures : biologie, dépistage et stratégie d’intervention.
1. Chercheur (CÉROM); 2. Agronome (MAPAQ)
Les captures actuelles d’adultes de la cécidomyie du chou-fleur (CCF) pour les sites en canola de printemps suivis par le RAP Grandes cultures montrent que les populations sont faibles. Toutefois, certains sites ont des captures moyennes à élevées en Abitibi-Témiscamingue (Nédélec et Lorrainville) et au Saguenay–Lac-Saint-Jean (Hébertville, Saguenay et Saint-Félicien). Les données de piégeage sont accessibles ici.
Lorsque les conditions sont propices au développement de la CCF, il peut y avoir jusqu’à quatre pics de captures des adultes (mouches). Les mouches déposent alors leurs œufs en grappe près des points de croissance des plants de canola. Les dommages causés par les jeunes larves s’alimentant des tissus végétaux peuvent s’observer 5 à 10 jours après ces pics. Selon les prévisions météorologiques, une remontée des populations pourrait aussi survenir dans les prochains jours, car les températures chaudes (25 °C) et une humidité relative élevée contribuent à la croissance des populations.
Le canola est actuellement entre le stade « 4 feuilles » et le stade « début bouton » pour les sites dépistés par le RAP. Puisque les stades « rosette » et « élongation » sont les plus sensibles aux dommages causés par les larves de CCF et que la plupart des champs sont en voie d’atteindre ces stades, il est recommandé d’être vigilant et de suivre attentivement les populations. La meilleure façon d’évaluer le risque pour un champ est de dépister l’insecte à l’aide de pièges à phéromone. Depuis le début du suivi de cet insecte par le RAP, on constate que les captures peuvent être très variables d’un champ à l’autre, même au sein d’une même municipalité. Un dépistage est donc recommandé pour chaque champ en canola.
Ce sont surtout les champs semés tardivement qui sont les plus à risque. Durant les stades sensibles, la CCF peut causer le chiffonnement ou la courbature des feuilles, la déformation des bourgeons et la mort du point végétatif ou de l’inflorescence produisant des cicatrices de texture liégeuse. Lors d’infestation sévère, elle peut causer l’arrêt de l’élongation de la tige principale du canola ou induire la mort du bourgeon terminal. Plus tard en saison, les plants endommagés présentent des bouquets de siliques; générant des retards dans la maturité du canola.
Toutefois, la grande capacité de compensation du canola peut réduire l’impact sur le rendement de ce ravageur, même en présence d’une population abondante de CCF. En effet, des données préliminaires issues de travaux réalisés au Québec ne montrent aucune relation entre le taux de capture de CCF et le rendement en canola à des densités inférieures à 40 CCF adultes/piège/jour. Une légère tendance à la baisse du rendement est cependant observée avec des captures supérieures. Ces observations font actuellement l’objet d’une étude plus approfondie visant à déterminer le seuil économique d’intervention pour le Québec. L’application d’un insecticide pourrait ainsi être envisagée uniquement en dernier recours.
Pour en savoir davantage sur la méthode de dépistage, l’identification et les stratégies à adopter pour surveiller ce ravageur, consultez la fiche technique La cécidomyie du chou-fleur ou le Guide des ravageurs et des ennemis naturels du canola au Québec.
RISQUES D’INFECTION DE LA FUSARIOSE DE L’ÉPI DANS LE BLÉ D’AUTOMNE :
VARIABLES SELON LES RÉGIONS
Tanya Copley1, Véronique Samson2 et Marie-Edith Cuerrier2
1. Chercheuse (CÉROM); 2. Agronome (MAPAQ)
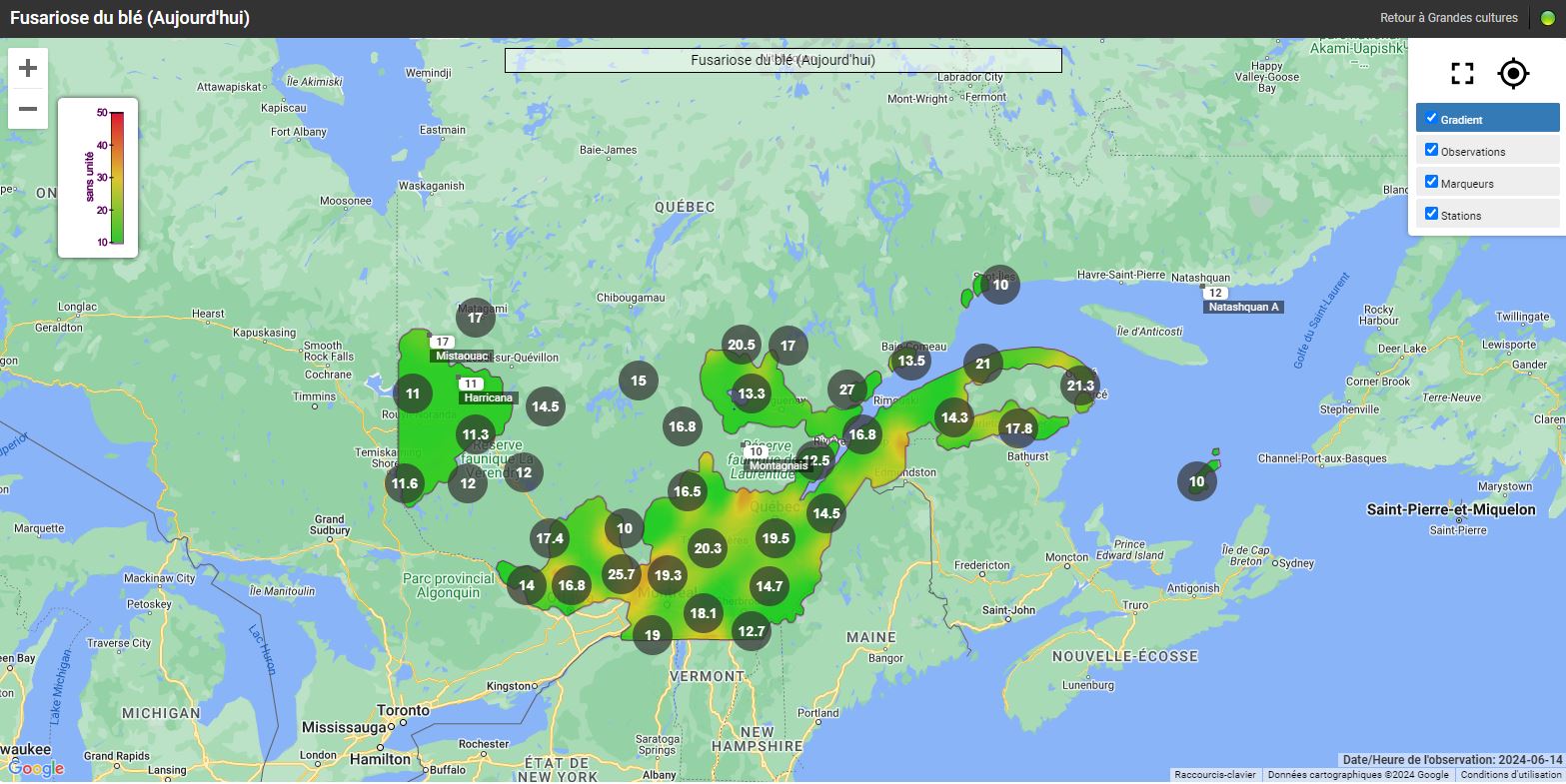
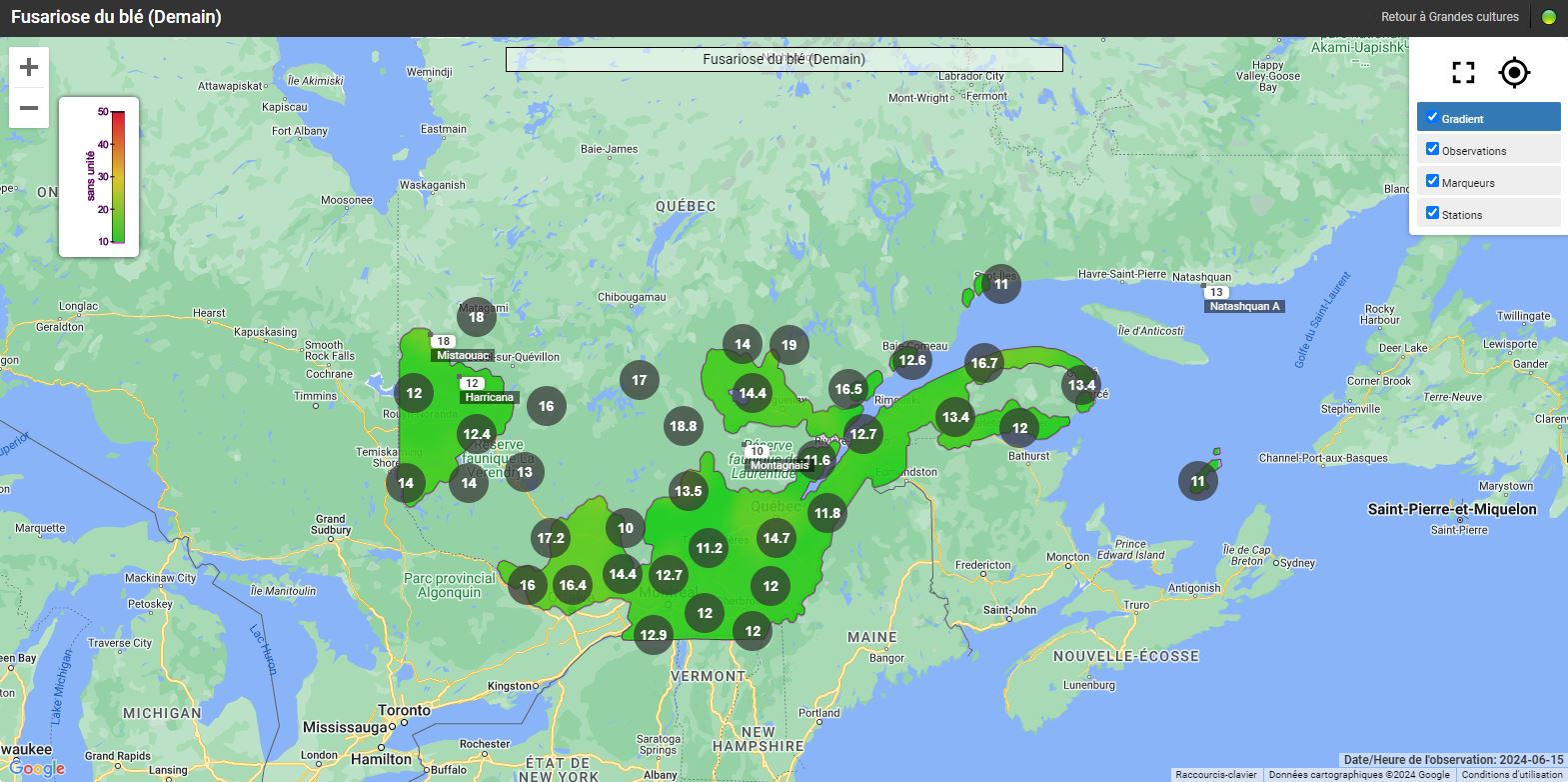
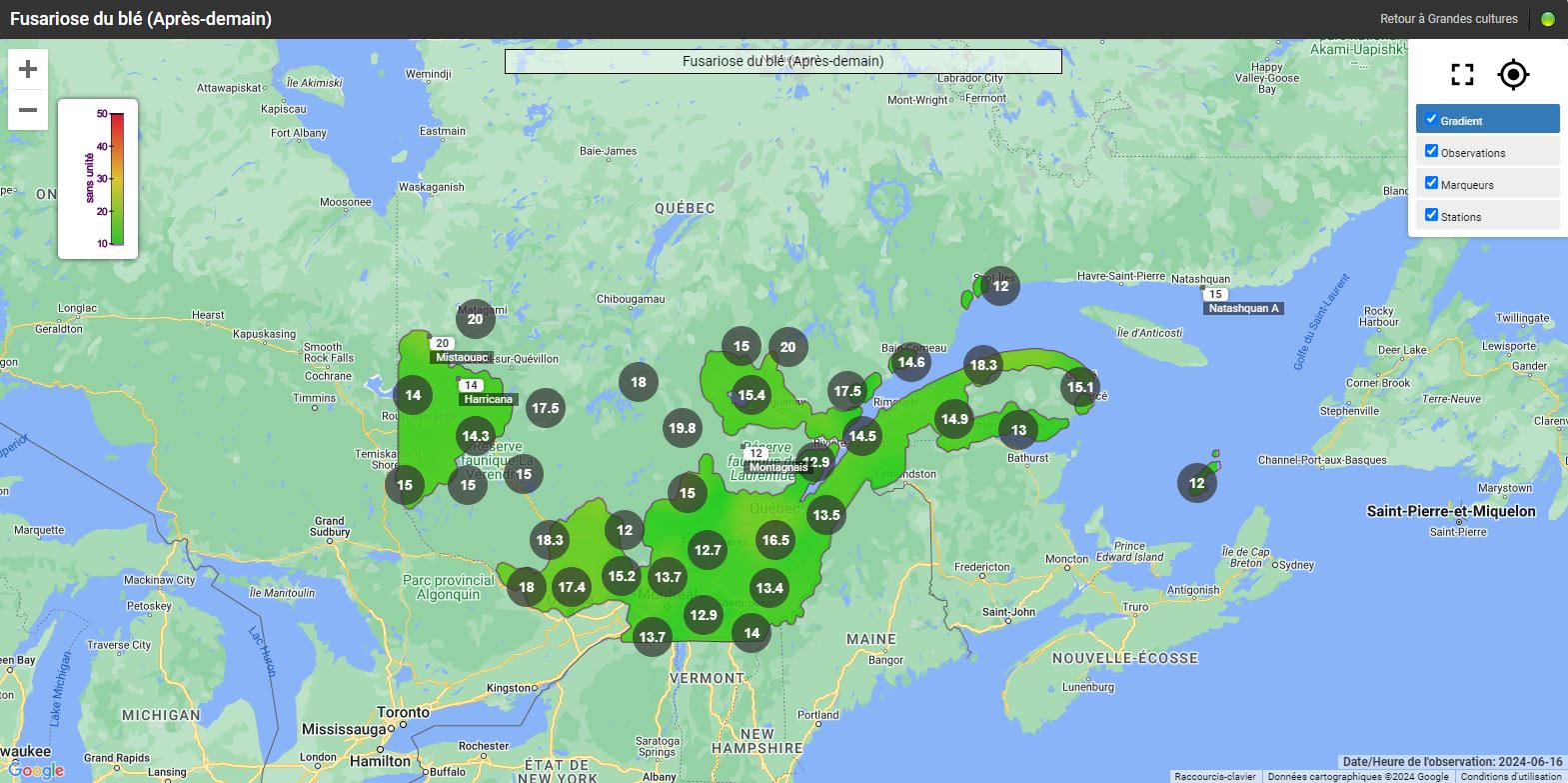
Les risques d’infection de la fusariose de l’épi sont variables selon les régions et le stade du blé d’automne. Pour certaines régions, le blé d’automne est déjà aux stades du remplissage des grains et les champs ne sont plus considérés à risque. Pour les régions plus périphériques, comme Lanaudière, l’Estrie, Chaudière-Appalaches et le Saguenay–Lac-Saint-Jean, le blé d’automne est présentement en floraison (stade à surveiller) ou le sera sous peu. Si les champs sont en préfloraison ou en floraison, il est important de consulter les cartes interactives sur le nouveau site Web d’Agrométéo Québec et de suivre l’évolution du stade du blé. L’infection par Fusarium graminearum est fortement associée aux variables climatiques suivantes : les précipitations, l’humidité et la température de l’air. Pour qu’il y ait une infection par le champignon, le blé doit être au stade « floraison ». Lorsque les conditions sont propices, les anthères sont la porte d’entrée du pathogène dans l’épi. Si la floraison est terminée, le risque d’infection est à peu près nul.
Les cartes interactives d'Agrométéo Québec présentent les niveaux de risque d’infection (voir les cartes ci-dessous en date du 14 juin). Selon les conditions météorologiques, les niveaux peuvent varier de Bas (0 à 25) à Moyen (25 à 35) et finalement à Élevé (35 à 50), représentés respectivement par les codes de couleur vert, orange et rouge.
D'autres facteurs de risque comme le cultivar, le précédent cultural et d'autres encore peuvent avoir un effet sur la gravité de la maladie. Pour en savoir davantage, consultez la section L’évaluation du risque d’infection par la fusariose de l’épi et l’interprétation du niveau de risque de l’avertissement N° 9 du 23 juin 2020. En cas de risque « moyen », ces facteurs de risque peuvent permettre de mieux évaluer le niveau de risque.
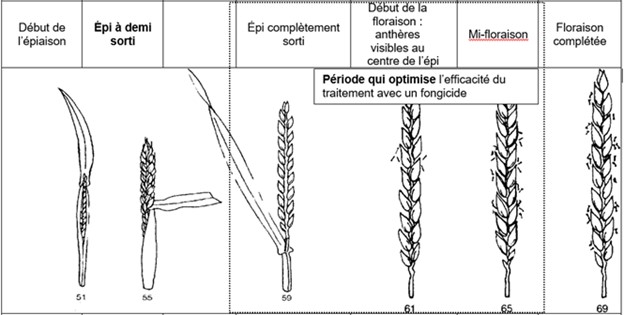
Si une intervention avec un fongicide est justifiée, le traitement doit être réalisé avant la mi-floraison du blé pour être efficace. Plus de 70 % des épis doivent se situer entre le stade début floraison (début de la sortie des anthères) et le stade mi-floraison (50 % des anthères sont sorties; voir le schéma ci-dessous). L’application du fongicide doit donc être faite en minimisant la proportion des épis dont la floraison est complétée. La fenêtre d’intervention avec un fongicide est très courte, d’où l’importance de suivre de près les conditions météorologiques et le stade de développement du blé afin d’intervenir, s’il y a lieu, au moment et dans des conditions qui favoriseront l’efficacité du traitement.
L'IMPORTANCE DE VÉRIFIER L’EFFICACITÉ D’UN TRAITEMENT HERBICIDE APRÈS UNE INTERVENTION
1. Agronome (MAPAQ); 2. Chercheuse (CÉROM)
Plusieurs champs ont reçu un traitement herbicide dans les dernières semaines; il importe de vérifier l’efficacité du traitement après une intervention. Pour ce faire, visitez les champs une à deux semaines après l’application. Selon les situations, plus d’un dépistage pourrait être requis. Pour certains herbicides, les effets sont visibles après quelques jours seulement, alors que d’autres produits prendront plus de temps pour agir de manière optimale sur les populations de mauvaises herbes.
Les éléments à considérer lors du dépistage suivant une intervention incluent les espèces de mauvaises herbes présentes, leur stade de croissance, leur localisation et l’abondance de celles-ci. Il faut aussi évaluer l'efficacité du traitement (% de mauvaises herbes contrôlées par rapport à une zone non traitée). Prenez en note également le stade de la culture et son état général, dans le cas où une intervention de correction s’avérerait nécessaire. Profitez-en également pour vérifier si la culture présente des signes de phytotoxicité ou de carences.
Ce dépistage permettra également d’observer si des espèces ont survécu au traitement herbicide. Différentes causes fonctionnelles sont attribuables à une mauvaise efficacité d’un traitement, telles que l’utilisation d’un produit peu efficace ou non homologué pour les principales espèces présentes, le non-respect des conditions d’utilisation inscrites sur l’étiquette (stade des mauvaises herbes, dose du produit, volume de bouillie, adjuvant, etc.), des conditions météorologiques défavorables, une défectuosité ou un mauvais réglage du pulvérisateur, etc. Si ces causes n’expliquent pas le mauvais contrôle obtenu, les éléments suivants peuvent renforcer l’hypothèse de la résistance :
- Une seule espèce de mauvaise herbe a survécu au traitement;
- Les mauvaises herbes sont distribuées aléatoirement dans le champ ou concentrées dans les entrées de champs;
- Le niveau de dommage sur les mauvaises herbes est variable d’un plant à l’autre;
- Le problème est récurrent;
- Des herbicides du même groupe ont été utilisés à répétition au cours des dernières années.
Si une résistance à un herbicide est soupçonnée, des échantillons peuvent être envoyés au Laboratoire d'expertise et de diagnostic en phytoprotection (LEDP) du MAPAQ pour la réalisation de tests de détection de la résistance aux herbicides. Consultez ce document pour connaître tous les tests moléculaires disponibles au LEDP. Les résultats sont généralement disponibles dans un court délai permettant une prise de décision rapide sur les différentes stratégies à mettre en place pour le contrôle des mauvaises herbes résistantes. Si le test moléculaire n’est pas disponible pour l’espèce ou le groupe d’herbicide souhaité, il est possible de réaliser des tests classiques. Il suffit d’envoyer au LEDP un échantillon de graines matures de la population soupçonnée d’être résistante.
Pour plus d’information sur le diagnostic de la résistance des mauvaises herbes aux herbicides, consultez le billet Votre trousse « résistance des mauvaises herbes » pour 2024. Pour consulter les divers services en malherbologie du LEDP, consulter le communiqué suivant. Le portrait de la résistance des mauvaises herbes au Québec peut être consulté en cliquant ici.
| Toute intervention envers un ennemi des cultures doit être précédée d’un dépistage et de l’analyse des différentes stratégies d’intervention applicables (prévention et bonnes pratiques, lutte biologique, physique et chimique). Le Réseau d’avertissements phytosanitaires (RAP) préconise la gestion intégrée des ennemis des cultures et la réduction des pesticides et de leurs risques. |
Pour des renseignements complémentaires, vous pouvez contacter l’avertisseure du sous-réseau Grandes cultures ou le secrétariat du RAP. Édition : Marianne St-Laurent, agr., M. Sc. et Cindy Ouellet (MAPAQ). La reproduction de ce document ou de l’une de ses parties est autorisée à condition d'en mentionner la source. Toute utilisation à des fins commerciales ou publicitaires est cependant strictement interdite.