Premières observations du puceron du soya. Légionnaire uniponctuée : faibles captures de papillons et dépistage de larves à prévoir. Charançon de la silique en Chaudière-Appalaches. Cécidomyie du chou-fleur : suivi recommandé en Abitibi-Témiscamingue et au Saguenay–Lac-Saint-Jean. Charançon postiche de la luzerne. Risque de fusariose de l'épi et de la rouille jaune dans le blé. Mouchetures physiologiques dans le blé. Causes possibles du soya pâle ou jaune. Désherbage : plusieurs cas de phytotoxicité. Dépistage de l'amarante tuberculée et contrôle postlevée. Contrôle du chénopode blanc en canicule. Causes possibles du problème de contrôle du chénopode avec glyphoste.
PREMIÈRES OBSERVATIONS DE PUCERONS DU SOYA EN MONTÉRÉGIE
S. Mathieu1, B. Duval1, J. Breault1 et V. Samson1
1. Agronome (MAPAQ)
1. Agronome (MAPAQ)
Des populations de pucerons du soya ont été observées dans certains champs de soya en Montérégie. Dès la mi-juin, il est courant de voir un nombre élevé de pucerons sur quelques plants de soya dans des foyers localisés. D’ici les prochaines semaines, ces pucerons pourraient produire une génération de pucerons ailés, leur permettant de se répartir dans le champ ou de migrer.
Dépister les champs est la première étape pour bien évaluer la situation
Examinez au moins 30 plants bien distribués dans le champ afin de déterminer l’abondance moyenne de pucerons par plant et la présence d’ennemis naturels. La présence de fourmis peut vous aider à localiser les pucerons puisqu’elles s’alimentent du miellat qu'ils produisent.LÉGIONNAIRE UNIPONCTUÉE : FAIBLES CAPTURES DE PAPILLONS et
DÉPISTAGE DE LARVES À PRÉVOIR DANS CERTAINS SECTEURS
S.Mathieu1, B. Duval1, V. Samson1 et J. Saguez2
1. Agronome (MAPAQ); 2. Chercheur (CÉROM)
DÉPISTAGE DE LARVES À PRÉVOIR DANS CERTAINS SECTEURS
S.Mathieu1, B. Duval1, V. Samson1 et J. Saguez2
1. Agronome (MAPAQ); 2. Chercheur (CÉROM)
Depuis le début de la saison, les captures de papillons de légionnaire uniponctuée sont faibles dans la majorité des pièges installés par le RAP Grandes cultures. Cependant, quelques sites situés dans les régions de Lanaudière, de la Montérégie-Est et de l’Outaouais ont atteint 100 captures/piège, soit le seuil requis pour amorcer le dépistage des champs à risque de présenter des dommages (voir les données ici).
Le graphique ci-dessous montre l’évolution des captures moyennes de papillons de légionnaire uniponctuée pour la province en 2024. Au Québec, la légionnaire uniponctuée peut causer des dommages importants de façon sporadique. La dernière année où plusieurs champs ont été affectés par les larves de cet insecte remonte à 2017.
Attention, les quantités de papillons capturés ne reflètent pas nécessairement l'intensité des infestations de larves et des dommages. Un dépistage des larves peut être envisagé dans les champs à risque situés dans des secteurs où des papillons ont été capturés :
Le dépistage doit se faire tôt le matin ou en soirée, au moment où les larves sont les plus actives. Le jour, elles se cachent dans la végétation dense et versée ainsi qu'au niveau du sol, sous les débris. Par temps nuageux, il est possible que les larves se retrouvent à l’intérieur du cornet des plants de maïs et sur les épis des céréales. Puisque les larves se nourrissent en commençant à la base des plants, on doit chercher les dommages à ce niveau.
Attention de ne pas confondre les larves de la légionnaire uniponctuée avec les larves d’autres espèces comme les vers gris ou l’hespérie des graminées. Des larves de légionnaire uniponctuée à différents stades de développement ainsi que différentes couleurs peuvent être observées au même moment, dans un même champ.
Pour en savoir plus, consultez La légionnaire uniponctuée : identification, dépistage et stratégie d’intervention.
Le Centre de recherche sur les grains (CÉROM) est à la recherche de larves de légionnaire uniponctuée pour évaluer la présence d’ennemis naturels. Si vous trouvez des larves et que vous pouvez les faire parvenir au CÉROM, contactez le RAP pour les détails de l’envoi (rapcerom@cerom.qc.ca).
Les premiers dépistages du charançon de la silique ont débuté cette semaine en Chaudière-Appalaches. Les deux champs dépistés jusqu’à maintenant comportent des populations se situant à l’intérieur du seuil d’intervention économique de 20 à 40 adultes par 10 coups de filet fauchoir avec un total de 39 et 29 charançons/10 coups de filet. Pour rappel, des populations particulièrement élevées avaient été observées l’an passé dans cette même région et en Abitibi-Témiscamingue (142 et 63 adultes/10 coups de filet, respectivement). La surveillance dans ces régions est donc fortement recommandée, particulièrement lorsque le stade sensible de 10-20 % de floraison du canola sera atteint. C’est à ce stade qu’il est possible de déterminer si le nombre de charançons capturés justifie un traitement insecticide. Le seuil économique de dommages est de 25 % de siliques trouées.
Le dépistage de ce ravageur se fait une fois par semaine à l’aide d’un filet fauchoir à cinq stations réparties aléatoirement dans le champ dès l’apparition des premiers boutons floraux (BBCH 50) jusqu’à la fin de la floraison (BBCH 69). Actuellement, peu de sites pour ce ravageur ont été dépistés, plusieurs champs n’ayant pas encore atteint le stade d’apparition des boutons floraux. Les champs semés plus tardivement seront à surveiller dans les prochaines semaines. Le dépistage doit être réalisé champ par champ, car la situation peut varier énormément d'un champ à l'autre sur une même entreprise.
Le charançon de la silique peut être contrôlé par des guêpes parasitoïdes. Ces ennemis naturels se retrouvent dans toute la province et leur présence peut contribuer à limiter les dommages. Il est donc important de s’assurer que l’utilisation d’insecticides est justifiée pour ne pas éliminer inutilement ces parasitoïdes ainsi que les autres ennemis naturels. Le traitement insecticide devrait être envisagé uniquement en dernier recours.
Important : si un traitement insecticide est envisagé, il doit être réalisé aux stades 10-20 % de floraison du canola (BBCH 61 - 62) et en présence de charançons adultes. Une intervention plus tôt est inefficace, car de nouveaux individus pourraient pondre au stade critique. Un traitement plus tardif ne permettra pas d’atteindre les larves se développant à l’intérieur des siliques. Si les captures à l’aide du filet sont limitées à une zone particulière du champ, il est possible de traiter uniquement cette section. Pour connaître les insecticides homologués et les conditions d’application, consultez le site Web SAgE pesticides. Ces produits sont efficaces contre les adultes seulement et une majorité de ceux-ci ne peuvent être appliqués qu’une seule fois dans la saison.
Pour plus d’information, consultez la fiche technique Le charançon de la silique ou encore le Guide des ravageurs et des ennemis naturels du canola au Québec.
Le graphique ci-dessous montre l’évolution des captures moyennes de papillons de légionnaire uniponctuée pour la province en 2024. Au Québec, la légionnaire uniponctuée peut causer des dommages importants de façon sporadique. La dernière année où plusieurs champs ont été affectés par les larves de cet insecte remonte à 2017.
Attention, les quantités de papillons capturés ne reflètent pas nécessairement l'intensité des infestations de larves et des dommages. Un dépistage des larves peut être envisagé dans les champs à risque situés dans des secteurs où des papillons ont été capturés :
- Les champs de céréales de printemps et de maïs semés tardivement et mal désherbés (particulièrement les endroits où il y a eu présence ou avec présence de chiendent);
- Les peuplements denses de céréales et de graminées vivaces;
- Les prairies situées à proximité des cours d'eau.
Le dépistage doit se faire tôt le matin ou en soirée, au moment où les larves sont les plus actives. Le jour, elles se cachent dans la végétation dense et versée ainsi qu'au niveau du sol, sous les débris. Par temps nuageux, il est possible que les larves se retrouvent à l’intérieur du cornet des plants de maïs et sur les épis des céréales. Puisque les larves se nourrissent en commençant à la base des plants, on doit chercher les dommages à ce niveau.
Attention de ne pas confondre les larves de la légionnaire uniponctuée avec les larves d’autres espèces comme les vers gris ou l’hespérie des graminées. Des larves de légionnaire uniponctuée à différents stades de développement ainsi que différentes couleurs peuvent être observées au même moment, dans un même champ.
Pour en savoir plus, consultez La légionnaire uniponctuée : identification, dépistage et stratégie d’intervention.
Le Centre de recherche sur les grains (CÉROM) est à la recherche de larves de légionnaire uniponctuée pour évaluer la présence d’ennemis naturels. Si vous trouvez des larves et que vous pouvez les faire parvenir au CÉROM, contactez le RAP pour les détails de l’envoi (rapcerom@cerom.qc.ca).
CHARANÇON DE LA SILIQUE : ABONDANCES ÉLEVÉES EN CHAUDIÈRE-APPALACHES
S. Boquel1, H. Brassard2 et V. Samson2
1. Chercheur (CÉROM); 2. Agronome (MAPAQ)
S. Boquel1, H. Brassard2 et V. Samson2
1. Chercheur (CÉROM); 2. Agronome (MAPAQ)
Les premiers dépistages du charançon de la silique ont débuté cette semaine en Chaudière-Appalaches. Les deux champs dépistés jusqu’à maintenant comportent des populations se situant à l’intérieur du seuil d’intervention économique de 20 à 40 adultes par 10 coups de filet fauchoir avec un total de 39 et 29 charançons/10 coups de filet. Pour rappel, des populations particulièrement élevées avaient été observées l’an passé dans cette même région et en Abitibi-Témiscamingue (142 et 63 adultes/10 coups de filet, respectivement). La surveillance dans ces régions est donc fortement recommandée, particulièrement lorsque le stade sensible de 10-20 % de floraison du canola sera atteint. C’est à ce stade qu’il est possible de déterminer si le nombre de charançons capturés justifie un traitement insecticide. Le seuil économique de dommages est de 25 % de siliques trouées.
Le dépistage de ce ravageur se fait une fois par semaine à l’aide d’un filet fauchoir à cinq stations réparties aléatoirement dans le champ dès l’apparition des premiers boutons floraux (BBCH 50) jusqu’à la fin de la floraison (BBCH 69). Actuellement, peu de sites pour ce ravageur ont été dépistés, plusieurs champs n’ayant pas encore atteint le stade d’apparition des boutons floraux. Les champs semés plus tardivement seront à surveiller dans les prochaines semaines. Le dépistage doit être réalisé champ par champ, car la situation peut varier énormément d'un champ à l'autre sur une même entreprise.
Le charançon de la silique peut être contrôlé par des guêpes parasitoïdes. Ces ennemis naturels se retrouvent dans toute la province et leur présence peut contribuer à limiter les dommages. Il est donc important de s’assurer que l’utilisation d’insecticides est justifiée pour ne pas éliminer inutilement ces parasitoïdes ainsi que les autres ennemis naturels. Le traitement insecticide devrait être envisagé uniquement en dernier recours.
Important : si un traitement insecticide est envisagé, il doit être réalisé aux stades 10-20 % de floraison du canola (BBCH 61 - 62) et en présence de charançons adultes. Une intervention plus tôt est inefficace, car de nouveaux individus pourraient pondre au stade critique. Un traitement plus tardif ne permettra pas d’atteindre les larves se développant à l’intérieur des siliques. Si les captures à l’aide du filet sont limitées à une zone particulière du champ, il est possible de traiter uniquement cette section. Pour connaître les insecticides homologués et les conditions d’application, consultez le site Web SAgE pesticides. Ces produits sont efficaces contre les adultes seulement et une majorité de ceux-ci ne peuvent être appliqués qu’une seule fois dans la saison.
Pour plus d’information, consultez la fiche technique Le charançon de la silique ou encore le Guide des ravageurs et des ennemis naturels du canola au Québec.
CÉCIDOMYIE DU CHOU-FLEUR DANS LE CANOLA : POPULATIONS GÉNÉRALEMENT FAIBLES MAIS SUIVI TOUJOURS RECOMMANDÉ EN ABITIBI-TÉMISCAMINGUE ET AU SAGUENAY–LAC-SAINT-JEAN
S. Boquel1, H. Brassard2 et V. Samson2
1. Chercheur (CÉROM); 2. Agronome (MAPAQ)
Les résultats des captures d’adultes de la cécidomyie du chou-fleur en date du 20 juin montrent que la majorité des sites ont des populations faibles. Pour certains sites situés en Abitibi-Témiscamingue et au Saguenay–Lac-Saint-Jean, les populations sont plus élevées. Cependant, les conditions météorologiques actuelles favorisent la croissance rapide des plants de canola, contribuant à l’atteinte de stades moins sensibles à la cécidomyie du chou-fleur. Les données de piégeage sont accessibles ici.
Pour rappel, les stades « rosette » et « élongation » sont les plus sensibles aux dommages causés par les larves de cécidomyie du chou-fleur. La plupart des champs de canola ont atteint ou sont en voie d’atteindre ces stades. Il est donc recommandé d’être vigilant et de suivre attentivement les populations à l’aide de pièges à phéromones.
Pour en savoir davantage sur la méthode de dépistage, l’identification de l’insecte, les dommages qu’il cause et les stratégies à adopter pour surveiller ce ravageur, consultez l'avertissement N° 7 du 14 juin 2024 et la fiche technique La cécidomyie du chou-fleur, ou encore, le Guide des ravageurs et des ennemis naturels du canola au Québec.
Les collaborateurs du RAP Grandes cultures procèdent actuellement au dépistage des cicadelles dans les luzernières. Lors de ces dépistages, les insectes retrouvés dans les filets fauchoirs sont nombreux. Il est notamment possible de trouver des cicadelles et des pucerons, mais aussi des charançons postiches de la luzerne. Ces derniers font partie des principaux ravageurs de la luzerne. Actuellement, les charançons sont observés sous forme de larves dans les filets; elles ont notamment été rapportées en Outaouais et en Estrie.
Les larves de ce charançon mesurent entre 4,0 et 7,0 mm de long. Elles sont reconnaissables grâce à leur tête noire et leur corps vert muni d’une ligne dorsale plus claire et de petits tubercules noirs.
Les larves grimpent jusqu'aux jeunes pousses et s’en alimentent. Les dommages qui peuvent être observés sont caractérisés par une multitude de trous de taille variable. Rapidement, le feuillage sèche et change de couleur pour prendre une teinte grisâtre ou blanchâtre. Une fois que les larves ont complété leur cycle de développement, elles restent sur le feuillage et tissent un cocon à l’intérieur duquel elles se transforment en pupe, puis quelques jours plus tard, en adulte. Il n’y a qu’une génération par an. Les adultes s’alimentent aussi du feuillage, mais en moins grande proportion que les larves.
Les larves du charançon postiche de la luzerne sont actuellement peu dommageables pour les luzernières, mais il est important de rapporter les cas au RAP grandes cultures (rapcerom@cerom.qc.ca) afin de documenter les possibles foyers d’infestation et l’évolution de ce ravageur au Québec.
RISQUE DE MALADIES DANS LES CHAMPS DE BLÉ : FUSARIOSE DE L’ÉPI ET ROUILLE JAUNE
T. Copley1, Y. Faucher2 et V. Samson2
1. Chercheuse (CÉROM); 2. Agronome (MAPAQ)
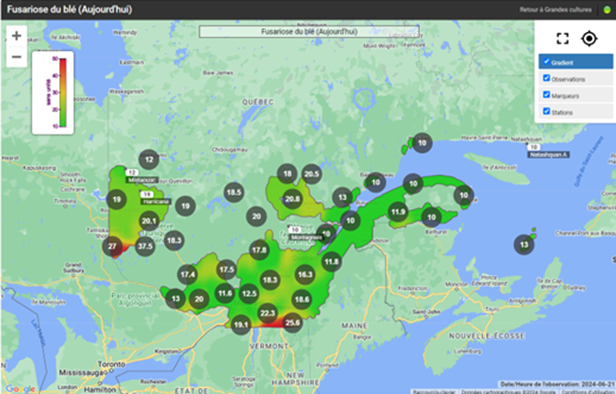
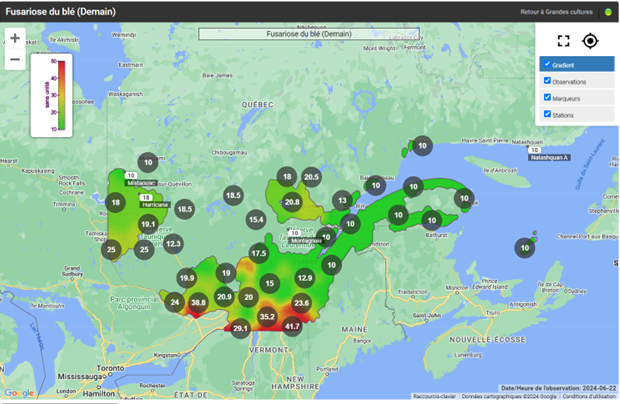
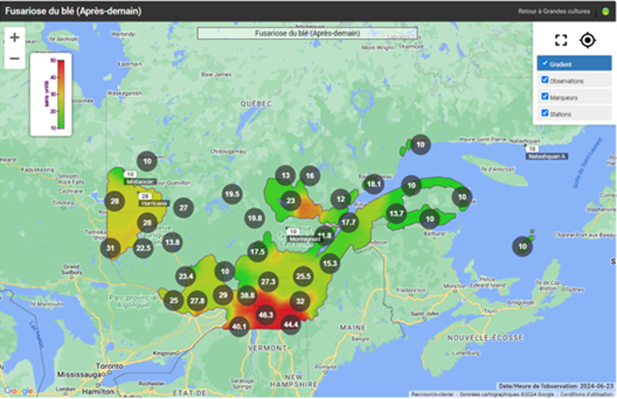
Fusariose de l’épi du blé
La majorité des champs de blé d’automne ont dépassé le stade de la floraison, tandis que certains champs de blé de printemps sont sur le point d’atteindre ce stade. Avec les températures élevées et la pluie annoncée dans les prochains jours, il faut rester vigilant pour les champs approchant les stades de la pré-floraison et de la floraison en ce qui concerne la fusariose de l’épi. Consultez les cartes interactives d’Agrométéo Québec afin de connaître le niveau de risque pour les différentes régions (voir les cartes ci-dessous en date du 21 juin). Pour de plus amples informations sur les facteurs de risque et la stratégie d’intervention, consultez l’avertissement N° 7 du 14 juin 2024.
Rouille jaune : Identification, dépistage et intervention
Dans plusieurs régions du Québec, la rouille jaune (Puccinia striiformis f. sp. tricitici) a été détectée dans le blé d’automne. En raison des stades avancés des céréales d’automne, aucune intervention n’est nécessaire. Cependant, la situation est à surveiller pour le blé de printemps.
La rouille jaune se présente sur les feuilles du blé par des pustules (lésions surélevées) jaune à orange de forme allongée disposées en lignes parallèles entre les veines de la feuille (photo). Un faible niveau d’infestation peut produire des conséquences importantes sur les rendements, surtout lorsque la feuille étendard est atteinte.
Un minimum d’un dépistage par semaine est recommandé lorsque la rouille jaune est présente dans une région, et au moins deux dépistages par semaine lorsqu’un champ est atteint par la maladie. Il faut prévoir une intervention lorsque 5 % des feuilles du champ sont atteintes ou avant que 5 % de la surface de la feuille étendard soit atteinte (environ 4 lésions d’un centimètre de longueur). Pour de plus amples informations, consultez le bulletin d'information N °2 du 12 juin 2018.
Un traitement fongicide pourrait être envisagé si le seuil économique d’intervention est atteint et que la culture est à un stade sensible (du tallage jusqu’à la floraison). Attention : certains produits homologués pour lutter contre la rouille contiennent des matières actives de la famille des strobilurines (groupe 11) qui peuvent augmenter le développement et la production de mycotoxines de la fusariose de l’épi lorsqu’appliqués après l’émergence de la feuille étendard. C’est d’autant plus important lorsque le blé est plus avancé (gonflement-épiaison). Dans ces situations, les fongicides à large spectre, qui permettent la répression de la fusariose, offriront également un contrôle de la rouille. Consultez les étiquettes afin d’intervenir aux bons stades de la culture, d’utiliser les doses recommandées et de respecter les délais avant la récolte.
(1) Tiré du Crop Protection Network : Efficacité du contrôle des maladies du blé considérant un moment d’application approprié (05/2023).
(2) Indice de risque pour la santé.
(3) Indice de risque pour l’environnement.
MOUCHETURES PHYSIOLOGIQUES DANS LE BLÉ : AUCUNE ACTION À POSER
16 juin 2023 : Y. Dion1 et T. Copley2
Révision 2024 : Y. Faucher1, J. Breault1 et V. Samson1
Agronome (MAPAQ); 2. Chercheuse (CÉROM)
Des cas de taches foliaires de source abiotique ont été identifié dernièrement dans les champs de blé d’automne. Il peut s’agir de mouchetures physiologiques (aussi connues comme des taches physiologiques ou du « flecking »). Les mouchetures physiologiques, prenant la forme de taches blanchâtres à jaune/brun, sont dues à des conditions physiologiques causées par des écarts brusques et importants de température ou d’éclairage (conditions nuageuses à ensoleillées). Certaines variétés sont plus susceptibles de présenter des mouchetures physiologiques que d’autres et la présence des taches variera d’une année à l’autre, selon les conditions météorologiques.
Les mouchetures physiologiques peuvent ressembler à des taches foliaires d'origine biotique (maladie). Deux trucs pour poser le bon diagnostic et différencier la moucheture physiologique des maladies foliaires : la moucheture physiologique est répartie plus uniformément dans le champ tandis qu’une maladie foliaire sera plus distribuée par zone. De plus, la moucheture physiologique se retrouve de façon plus uniforme sur le plant contrairement aux maladies qui, généralement, débutent sur les feuilles du bas. L’envoi d’un échantillon au Laboratoire d’expertise et de diagnostic en phytoprotection du MAPAQ pourra confirmer le diagnostic.
L’utilisation de fongicides n’a aucun effet sur les mouchetures physiologiques. De plus, les rendements sont très rarement affectés par celles-ci. À noter aussi qu’il est possible que certains adjuvants utilisés avec les fongicides foliaires puissent créer des taches sur les feuilles sous certaines conditions. Ces taches seront souvent plus présentes sur les feuilles du haut du plant.
Pour plus d’information, vous pouvez vous référer à un bulletin publié en Ontario (MAAARO) et à une page web du Gouvernement du Manitoba (en anglais).
SOYA PÂLE OU JAUNE EN DÉBUT DE SAISON : LES CAUSES POSSIBLES
B. Duval1 et V. Samson1
1. Agronome (MAPAQ)
En début de saison, il n’est pas rare que le soya soit de couleur vert pâle ou même jaunâtre. Outre l’effet variétal, plusieurs facteurs peuvent être en cause. Des pluies excessives et du temps frais peuvent faire pâlir certains champs de soya. En général, au retour du temps plus clément, les plants retrouveront leur verdeur. Dans certains cas, il pourrait s’agir de phytotoxicité, d’une maladie racinaire, d’une carence, d’une combinaison de facteurs, etc. La distribution des plants affectés à l’échelle du champ constitue un bon indice pour investiguer la cause de la coloration anormale du soya.
Rappelons qu’avant que les nodules du soya suffisent à la demande en azote de la plante, il est possible que les plants de soya subissent temporairement une légère carence. La carence en azote se manifestera d’abord sur les feuilles du bas. À mesure que le système racinaire se développe et que les nodules se forment, la couleur vert foncé du soya revient généralement d’elle-même en peu de temps, et il n’y a pas d’impact sur le rendement. À partir du stade V2 ou V3 du soya, des nodules devraient être présentes et actives; il s’agit donc d’un bon stade pour commencer à évaluer la nodulation du soya et intervenir au besoin.
Pour plus d’information, consultez :
- Soya jaune en début de saison : les causes possibles.
- Comment bien diagnostiquer les problèmes phytosanitaires en cultures de champ.
DÉSHERBAGE DES CULTURES : PLUSIEURS CAS DE PHYTOTOXICITÉ OBSERVÉS, PRÉCAUTIONS MULTIPLES À PRENDRE
M.-E. Cuerrier1, A. Marcoux1 et B. Duval1
1. Agronome (MAPAQ)
Plusieurs cas de phytotoxicité causés par des herbicides aux cultures principales ont été rapportés au RAP Grandes cultures dans la semaine du 17 juin. Les causes peuvent être multiples. Selon les cas reçus au Laboratoire d’expertise et de diagnostic en phytoprotection du MAPAQ, les causes les plus fréquemment associées aux problèmes de phytotoxicité sont les suivantes :
- La dérive d’herbicides vers des cultures non ciblées;
- La rémanence (carryover);
- Le mauvais rinçage du pulvérisateur;
- Des erreurs d’application (ou choix de produit et/ou d’adjuvant).
D’autres éléments peuvent être en cause, dont un stress à la culture lié aux conditions météorologiques, un problème lié au semis ou aux caractéristiques du sol, etc. Les symptômes de phytotoxicité peuvent être confondus avec ceux causés par d’autres facteurs, tels que des carences ou des excès en éléments nutritifs, des maladies ou des stress liés aux conditions météorologiques, etc. Certains traitements herbicides dirigés vers des cultures non ciblées ou employés dans de mauvaises conditions peuvent occasionner des altérations passagères à la culture alors que d’autres peuvent en causer la mort complète. Il est important d’établir un diagnostic précis de la problématique afin de planifier des interventions de correction, au besoin, dans les champs touchés. La fiche technique Phytotoxicités causées par les herbicides en grandes cultures : causes et diagnostic présente les principales causes rencontrées et propose une démarche diagnostique afin de bien établir la source du problème. Vous y trouverez également une liste de références utiles.
À ce temps-ci de la saison, portez une attention particulière aux éléments suivants :
- Applications tardives de glyphosate dans le maïs tolérant l’herbicide : respectez les stades maximaux du maïs inscrits à l’étiquette du produit. À cet effet, vous pouvez également consulter l'avertissement Nº 8 du 22 juin 2023;
- Rinçage et nettoyage du pulvérisateur : rincez et nettoyez le pulvérisateur et ses composantes selon les recommandations inscrites à l’étiquette du produit. En l’absence de directives à l’étiquette, contactez le représentant du produit utilisé ou consultez la procédure générale;
- Conditions météorologiques : évitez les temps caniculaires, les températures au-dessus de 27 ºC pour certains produits, les conditions météorologiques propices aux inversions de température et les vents au-dessus de 15 km/h.
Dans bien des cas, ces incidents peuvent être évités en lisant attentivement et en respectant les conditions d’utilisation et les mises en garde aux étiquettes des produits.
DÉPISTAGE DE L’AMARANTE TUBERCULÉE ET CONTRÔLE EN POSTLEVÉE
S. Mathieu1
1. Agronome (MAPAQ)
S. Mathieu1
1. Agronome (MAPAQ)
La chaleur des derniers jours pourrait avoir favorisé l’émergence de nouvelles plantules d’amarante tuberculée. Puisque cette mauvaise herbe émerge tout au cours de la saison, il est judicieux de dépister les champs même si un désherbage a été effectué en début de saison. Selon le stade de la culture et de la mauvaise herbe, des options sont possibles pour contrôler cette plante envahissante. Que l’intervention soit mécanique ou chimique, il est important d’intervenir avant que l’amarante tuberculée n’atteigne 10 centimètres de hauteur. Par temps chaud, sa croissance est impressionnante : elle peut croître de plusieurs centimètres en une seule journée.
L’amarante tuberculée présente des profils de résistance variés. Il est donc important de faire analyser la population présente sur votre entreprise et d’en tenir compte avant de choisir votre stratégie herbicide. Pour la saison 2024, le Laboratoire d'expertise et de diagnostic en phytoprotection (LEDP) du MAPAQ offre gratuitement des analyses biomoléculaires d’identification et de résistance des espèces d’amarantes. Pour plus d’information sur le prélèvement et l’envoi des échantillons, consultez le document Envoi des échantillons au LEDP.
La majorité des populations d’amarante tuberculée au Québec sont résistantes aux herbicides des groupes 2 et 9. Pour les options de traitements herbicides en postlevée, consultez SAgE pesticides. Le portail ontarien pour la protection des cultures permet également de rechercher des méthodes de lutte contre les mauvaises herbes et de comparer leur efficacité.
Il est à noter que cette liste n’est pas exhaustive. De plus, les noms commerciaux ne sont mentionnés qu’à titre d’exemple.
Consultez les étiquettes afin d’intervenir aux bons stades de la culture et des mauvaises herbes, et d’utiliser des adjuvants lorsque recommandés. Tenez compte également des autres particularités à respecter (ex. : texture de sol, pH, etc.) afin que l’efficacité des traitements soit optimale.
Pour plus d’information sur la plante et pour s’informer sur tous les moyens de lutte possible (cultural, mécanique, chimique), consultez la fiche technique Amarante tuberculée ainsi que Votre trousse « Résistance des mauvaises herbes » pour 2024.
CONTRÔLE DU CHÉNOPODE BLANC EN PÉRIODE DE CANICULE
S. Flores-Mejia1, A. Marcoux2 et B. Duval2
1. Chercheuse (CÉROM); 2. Agronome (MAPAQ)
Certains champs ont reçu un traitement herbicide dans la dernière semaine, alors que la canicule sévissait. Lorsque la température dépasse 26 °C, les applications de glyphosate pour contrôler le chénopode blanc sont déconseillées. En effet, le glyphosate appliqué sur le chénopode est alors rapidement transporté vers le bout des tiges et des racines (méristèmes apicaux), provoquant la mort uniquement de ces parties de la plante, ce qui empêche le transport du glyphosate dans le reste de la plante.
Si possible, il faudra adapter le désherbage en conséquence. Il est également important de réaliser un dépistage des champs une à deux semaines après l’application afin de vérifier l’efficacité du traitement. Si vous avez rencontré un problème de contrôle du chénopode à la suite d’une application de glyphosate, consultez l'avertissement N° 10 du 10 juillet 2019.
Si vous suspectez malgré tout être en présence de plants résistants au produit, vous pouvez envoyer un échantillon de graines matures pour réaliser le test classique de résistance au glyphosate; les tests moléculaires pour le chénopode n’étant disponibles que pour d’autres herbicides, soit les groupes 2 et 5. Consultez Votre trousse « Résistance des mauvaises herbes » pour 2024 pour accéder à la procédure de collecte et d’envoi d’échantillons au LEDP.
PROBLÈME DE CONTRÔLE DU CHÉNOPODE AVEC DU GLYPHOSATE : CAUSES POSSIBLES
19 juillet 2019 : I. Fréchette, agr. (CÉROM), S. Flores-Mejia1 et S. Mathieu2
Mise à jour 2024 : S. Flores-Mejia1, A. Marcoux2 et B. Duval2
1. Chercheuse (CÉROM); 2. Agronome (MAPAQ)
19 juillet 2019 : I. Fréchette, agr. (CÉROM), S. Flores-Mejia1 et S. Mathieu2
Mise à jour 2024 : S. Flores-Mejia1, A. Marcoux2 et B. Duval2
1. Chercheuse (CÉROM); 2. Agronome (MAPAQ)
Il est parfois possible d’observer des problèmes de contrôle du chénopode blanc avec du glyphosate. Ce phénomène pourrait être expliqué par différentes causes :
- La taille de la mauvaise herbe au moment de l’application : le contrôle par le glyphosate est plus difficile lorsque le chénopode atteint environ 15 cm, car la plante peut développer, dans ses feuilles, une couche de cire qui diminue l’efficacité des herbicides de contact. Selon les recherches de Nurse (AAFC) et Sikkema (Université de Guelph), pour contrôler des plants de chénopode de 30 cm, il faudrait une dose de glyphosate de près de 3 fois supérieure à celle pour contrôler des plants de 10 cm. Il est donc souhaitable de traiter hâtivement cette mauvaise herbe, puisqu’on évite alors de devoir augmenter les doses et ainsi de perdre du rendement.
- La température au moment de l’application : en condition de hautes températures (> 26 °C), le glyphosate appliqué sur le chénopode est rapidement transporté vers le bout des tiges et des racines (méristèmes apicaux). L’importante concentration de glyphosate dans ces parties de la plante provoque la mort de ses tissus végétaux et empêche le transport du glyphosate dans le reste de la plante, stimulant ainsi la croissance des tiges latérales.
- L’application du produit avant la pluie : la présence de pluie entre 30 minutes et 6 heures (dépendamment du produit) après l’application du glyphosate peut entraîner une réduction du contrôle des mauvaises herbes.
- L’utilisation de glyphosate en mélange avec certains produits : l’efficacité du glyphosate peut être réduite s’il est mélangé avec des herbicides à base de triazine (atrazine et simazine, groupe 5), de triazinone (métribuzine, groupe 5), d’herbicides à base d’urée comme le linuron (groupe 7) et de certains fertilisants foliaires ayant une charge positive, comme le manganèse. Afin de maximiser l’efficacité du glyphosate, il est plutôt recommandé de faire l’application en deux passages, un pour le glyphosate et un pour le manganèse.
- La qualité de l’eau employée pour le traitement : le glyphosate a une forte propension à se combiner avec les particules solides contenues dans l’eau, diminuant ainsi significativement son efficacité sur les mauvaises herbes; d’où l’importance d’utiliser une eau très limpide.
- La dureté de l’eau employée pour le traitement : cette mesure renseigne sur la quantité d’ions positifs contenus dans l’eau, qui sont surtout du calcium et du magnésium, et elle est généralement exprimée en mg/L (ou ppm) de CaCO3. Le glyphosate peut être affecté par la dureté de l’eau lorsque celle-ci dépasse 350 ppm.
Dans le cas du glyphosate, le type de sol n’a pas d’impact sur l’effet du traitement. Si vous avez rencontré un problème de contrôle du chénopode blanc avec du glyphosate et que vous suspectez être en présence de plants résistants au produit, vous pouvez envoyer un échantillon de graines matures pour réaliser le test classique de résistance au glyphosate. Consultez Votre trousse « Résistance des mauvaises herbes » pour 2024 pour accéder à la procédure de collecte et d’envoi d’échantillons au LEDP.
| Toute intervention envers un ennemi des cultures doit être précédée d’un dépistage et de l’analyse des différentes stratégies d’intervention applicables (prévention et bonnes pratiques, lutte biologique, physique et chimique). Le Réseau d’avertissements phytosanitaires (RAP) préconise la gestion intégrée des ennemis des cultures et la réduction des pesticides et de leurs risques. |
Pour des renseignements complémentaires, vous pouvez contacter l’avertisseure du sous-réseau Grandes cultures ou le secrétariat du RAP. Édition : Marianne St-Laurent, agr., M. Sc. et Sophie Bélisle (MAPAQ). La reproduction de ce document ou de l’une de ses parties est autorisée à condition d'en mentionner la source. Toute utilisation à des fins commerciales ou publicitaires est cependant strictement interdite.



.png)